Allez, aujourd’hui, on va parler des antibiotiques.
Comment nous soignent-ils ? Qu’est-ce qui les rend de moins en moins efficaces ? Et quelle est la méthode employée pour choisir celui qu’on va donner au patient ?
Un fil.
⬇️⬇️⬇️⬇️⬇️
Les antibiotiques sont des molécules qui agissent sur les bactéries, soit en les détruisant (dans ce premier cas, on dit qu’ils ont un effet bactéricide), soit en empêchant leur prolifération (on parle alors d’effet bactériostatique).
Contrairement à ce qu’on pourrait croire, les antibiotiques sont à la base des substances naturelles, fabriquées par des bactéries et des champignons qui s’en servent afin d’éliminer leurs concurrents pour l’accès à la nourriture, à l’eau ou à d’autres ressources limitées.
Il a fallu beaucoup de temps aux humains pour se rendre compte de leur existence.
Mais une fois qu’il les a découverts, l’Homme a alors entrepris de les isoler, puis fait en sorte de les reproduire (en les améliorant parfois) en laboratoire… tout en réussissant à fabriquer
un certain nombre d’antibiotiques synthétiques !
Grâce à leur concours, des millions de vies à travers le monde ont ainsi pu être sauvées.
Comment procèdent les antibiotiques pour agir sur une bactérie ?
En fait, c’est relativement simple : chacun d’entre eux a une cible bien spécifique parmi les différents composants de la bactérie dont vous pouvez voir un aperçu ci-dessous.
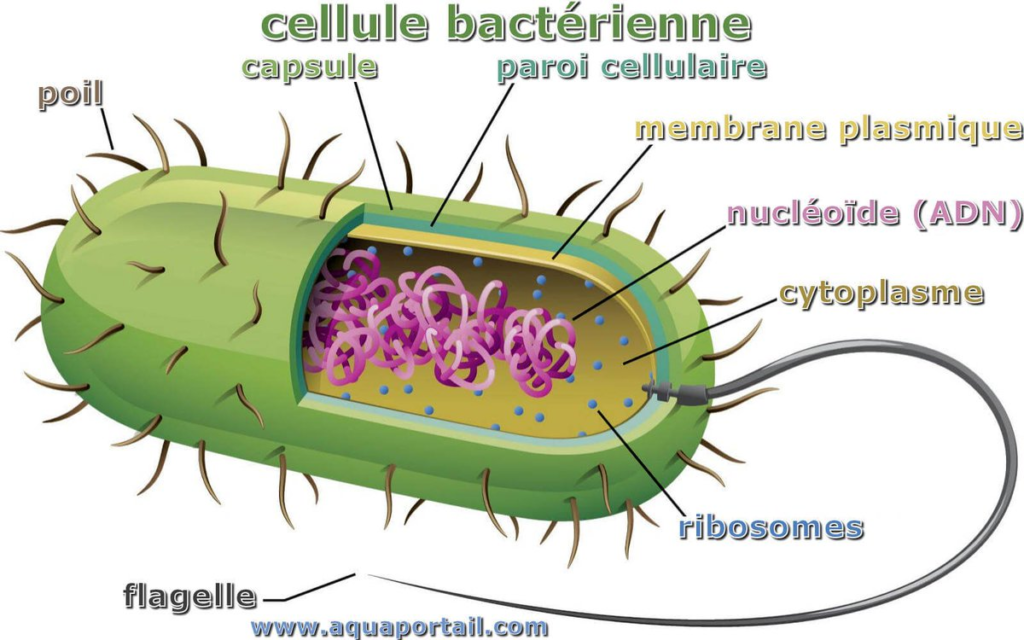
Certains, comme les pénicillines et les céphalosporines, vont inhiber la synthèse de la paroi.
D’autres, quant à eux, agiront sur la membrane plasmique, conduisant à la destruction de la bactérie (c’est le cas des polymyxines).

D’autres encore (les quinolones) vont empêcher la synthèse de l’ADN, et de ce fait la propagation de la bactérie qui en a besoin pour se multiplier.

Enfin, des antibiotiques comme les cyclines vont cibler les ribosomes (dont la fonction est de synthétiser des protéines), tandis que les sulfamides s’attaqueront aux enzymes (ce sont des protéines, si vous préférez) du cytoplasmes pour perturber le métabolisme de la bactérie.

Comme on le voit, les cibles potentielles sont nombreuses chez une bactérie.
Pourtant, elles ne vont pas toutes succomber aux antibiotiques : certaines y sont résistantes (on parle alors d’antibiorésistance), et cela pour deux raisons qu’il convient de distinguer.
Tout d’abord, il y a une résistance qu’on pourrait qualifier de naturelle, dans la mesure où elle a pour cause les caractéristiques innées de la bactérie.
Ces cas de résistance naturelle surviennent notamment quand la bactérie à traiter est dépourvue de la cible visée par l’antibiotique.
Par exemple, toutes les bactéries n’ont pas les mêmes enzymes.
Il en résulte que si un antibiotique cible une enzyme précise qui est absente
chez la bactérie qu’on veut traiter, l’antibio n’aura aucun effet sur cette dernière.

La deuxième cause de résistance aux antibiotiques, est une menace grave pour la Santé Publique humaine : il s’agit de la résistance acquise (la « vraie » antibiorésistance, en fait).
Elle correspond à l’apparition d’une résistance à un ou plusieurs antibios chez une bactérie
qui y était jusqu’alors sensible.
Cette résistance très problématique peut survenir via deux mécanismes.
Le premier, et le plus connu sans doute, c’est la mutation génétique.
En effet, ces mutations qui se produisent aléatoirement dans l’ADN de la bactérie ont parfois des effets positifs, susceptible de lui procurer un avantage sur les autres souches en présence d’un antibiotique.
Par exemple, si l’une de ces mutations bouleverse la structure d’une enzyme qui était justement la cible de l’antibiotique, alors l’antibio ne sera plus capable d’interagir avec cette enzyme nouvelle, et par conséquent, d’agir sur la bactérie mutante…
Or, puisque ces mutations surviennent aléatoirement, elles seront déjà présentes chez une fraction des bactéries que l’on traite avec l’antibiotique.
Les souches mutantes vont donc survivre, contrairement à celles qui y étaient sensibles à l’antibio.
Ainsi, il ne restera plus que des bactéries résistantes qui, fortes de leur avantage, vont maintenant proliférer à la place des anciennes souches.
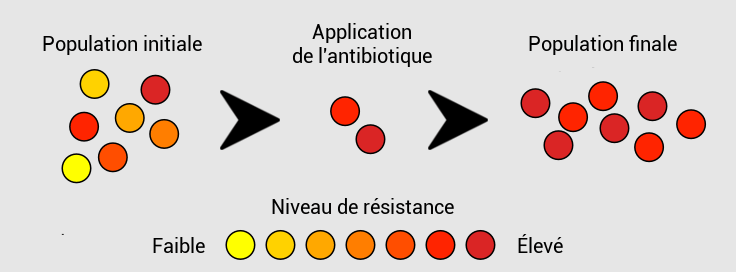
Bien sûr, si les bactéries n’avaient pas été exposées à l’antibiotique, les résistantes n’auraient pas eu d’avantage sur les autres, et le remplacement n’aurait donc pas eu lieu.
Voilà pourquoi on dit finalement que la mutation de résistance a été sélectionnée par le traitement.
Alors je ne pense pas vous donner un scoop, mais c’est en milieu hospitalier que se concentrent le plus de souches résistantes.
Pourquoi ? Car là-bas, on utilise massivement les antibiotiques pour éviter les complications infectieuses suite aux actes chirurgicaux sur des
patients souvent affaiblis.
C’est donc une bonne chose à court terme, mais à force d’usage intensif, on favorise nous-mêmes la sélection de souches résistantes…
L’arme est à double tranchant.
Le second mécanisme par lequel une souche bactérienne peut devenir résistante à un ou plusieurs antibios, c’est l’acquisition d’un plasmide.
Un plasmide, c’est une petite molécule d’ADN à deux brins, souvent circulaire, et qui est indépendante du véritable ADN de la bactérie.
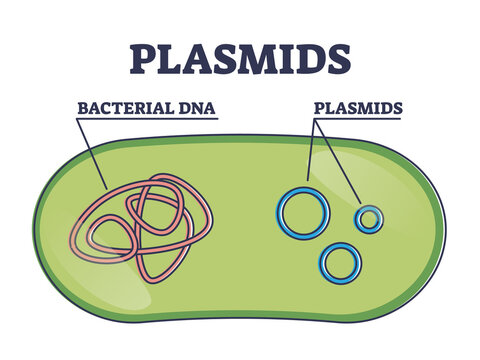
Ces plasmides, qui pourraient être qualifiés de parasites génétiques, ne sont pas essentiels à la vie de leur hôte bactérien, contrairement au véritable ADN ; seulement, ils transportent des gènes susceptibles de lui octroyer certains avantages !
Et parmi ces avantages, vous l’aurez compris, il y a celui de la résistance à un, ou plusieurs antibiotiques…
L’acquisition de tels plasmides peut s’effectuer par transfert d’une bactérie à l’autre via un phénomène qu’on appelle la conjugaison.
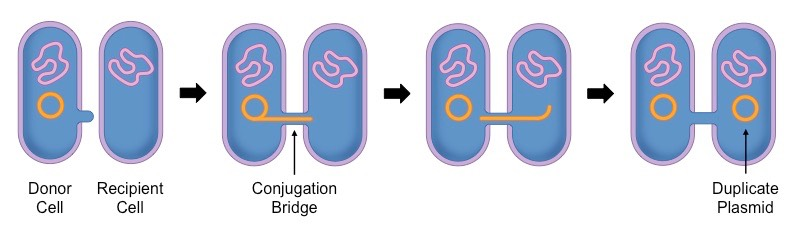
Concrètement, si l’une des bactéries responsables de votre infection rencontre une autre bactérie de votre corps qui détient le « plasmide de résistance à l’antibiotique », elle pourra donc éventuellement en hériter, et ainsi devenir insensible au traitement prescrit.

Il en résulte qu’aujourd’hui, les antibiotiques sont de moins en moins performants, et on ne peut pas toujours prédire lequel va marcher sur une infection bactérienne donnée.
On a donc besoin d’identifier les plus efficaces d’entre eux, et pour ce faire,
on réalise un antibiogramme – aussi appelé test de sensibilité aux antibiotiques.
Le procédé est simple : il s’agit de prélever la bactérie infectant un patient (via un échantillon biologique), puis de la mettre en culture avant de l’exposer à différents antibios,
pour savoir le(s)quel(s) empêche(nt) bien sa propagation. Le plus efficace sera alors choisi pour traiter le patient atteint.

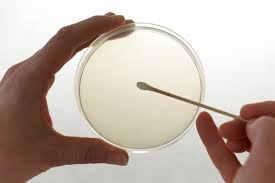
Pour réaliser cette expérience, il nous faut tout d’abord une boîte de Pétri contenant de la gélose (la gélose est une substance qui possède tout ce dont la bactérie a besoin pour proliférer).

On va ensuite étaler notre bactérie sur la gélose grâce à un écouvillon qui en est imprégné.
Le mieux est de faire des stries pour assurer la distribution uniforme du germe sur toute la surface de la boîte (et on n’oubliera pas de bien suivre les contours du cercle).
Une fois qu’on a bien tartiné (et donc ensemencé) la gélose, la prochaine étape consiste à appliquer sur cette dernière des pastilles imprégnées de différents antibiotiques.
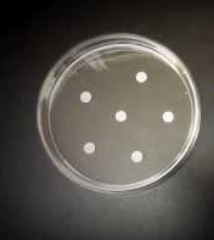
Dans une boîte de Pétri de 9 centimètres de diamètre, on pourra déposer jusqu’à 6 pastilles imprégnées chacune d’un antibio différent.
Attention : il faut bien appuyer sur chaque disque afin qu’il colle bien à la gélose, et on laissera pour chacun d’entre eux une distance de
2-3 cm avec le bord.
Après avoir fait tout ça, il suffit maintenant de laisser reposer notre préparation.
Cette période d’incubation pourra durer entre 15 et 20 heures à la louche.
Passé ce délai, des changements seront observables à l’intérieur de la boîte, où l’on ne voyait au départ que les disques posés sur la gélose transparente.
Désormais, cette gélose est recouverte d’un voile formée par les bactéries qui ont proliféré dans l’intervalle !
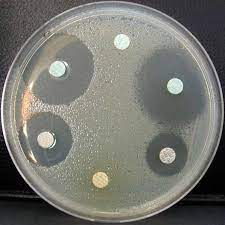
Malgré cette propagation de la bactérie, on constatera cependant, si on a un peu de chance, que certaines pastilles d’antibiotiques sont entourées de halos toujours transparents.
Ces zones dans lesquelles la bactérie n’a pas pu s’étendre sont appelées des halos d’inhibition.
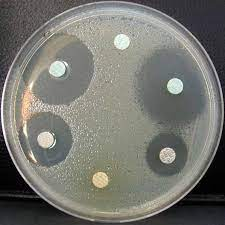
Si l’on observe un halo d’inhibition autour d’une pastille d’antibiotique, ça veut dire que l’antibiotique a empêché la propagation du germe dans son périmètre, et qu’il est donc efficace contre ce dernier.
Si par contre on voit que la bactérie a progressé jusqu’au disque,
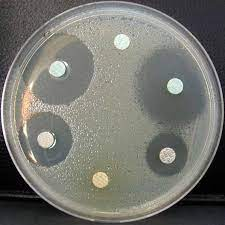
alors on sait que l’antibio dont ce disque est imprégné ne « marche pas » sur la bactérie en question.
On peut donc, d’ores et déjà éliminer tous les antibios qui ne sont pas cerclés d’un halo d’inhibition. 
Quant à ceux qui en possèdent, eh bien ! Pour eux non plus, on ne sait toujours pas à ce stade si on pourra les prescrire au patient.
En effet, bien qu’ils démontrent une certaine efficacité in vitro (c’est-à-dire, dans la boîte de Pétri), il nous reste à déterminer
s’ils fonctionnent à des doses acceptables pour l’Homme.
Parce que si l’antibio est efficace seulement à des doses dangereuses voire mortelles, ça ne sert à rien !
Il faut donc chercher, parmi les antibios efficaces, lequel d’entre eux le sera à des doses raisonnables pour l’Homme.
Et dans ce but, on va se fier à la taille (plus précisément, au diamètre) des différents halos d’inhibition, qu’on prendra la peine de mesurer avec soin.

Concrètement, plus un halo est étendu, plus il devient probable que l’antibio puisse être administré à faibles doses.
Pourquoi ? Parce qu’un halo étendu signifie que la bactérie a pu être inhibée même à de grandes distances de la pastille, c’est-à-dire là où les concentrations
d’antibio deviennent assez faibles.
En effet, bien que l’antibio soit capable de se diffuser dans la gélose, le fait est que plus on s’éloigne de la pastille, moins il y aura d’antibio (logique).
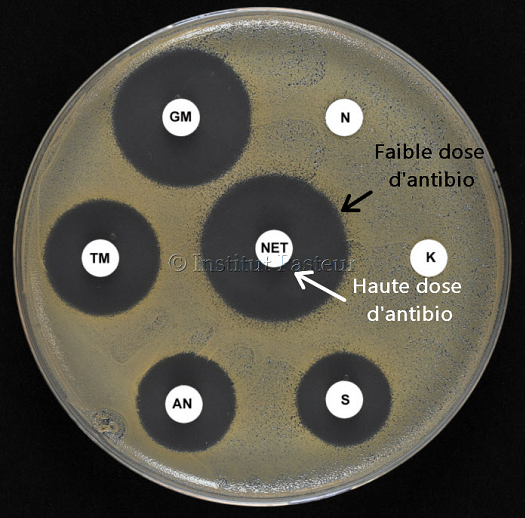
Donc pour résumer, si la bactérie s’est fait dégager sous ces concentrations minimes d’antibiotiques, ça veut dire que l’antibio marche à petite dose.
Voilà le principe.
Le diamètre du halo nous indique en fait si l’antibio pourra marcher à faible ou à forte dose. C’est un indicateur précieux.
Et vous savez quoi ? Puisque l’Homme est intelligent, il a réussi à savoir quelle dose correspondait à tel ou tel diamètre pour chaque antibiotique.
Cela nous a permis d’établir ce qu’on appelle des valeurs de référence pour chaque antibiotique.
Ces valeurs de référence sont en fait des seuils critiques, qui nous informent des diamètres limites à partir desquels un antibio pourra être ou non prescrit.
Il y a deux seuils par antibiotique. Le premier, qu’on note d, caractérise le diamètre qui correspond à la dose maximale tolérée chez le patient. C’est donc, comme vous l’aurez compris, la diamètre minimum que doit posséder le halo pour que l’antibio associé puisse être efficace.
Si le diamètre du halo est inférieur à ce seuil critique, il sera impossible de l’administrer car il ne fonctionne qu’à des doses dangereuses pour le patient.
Ainsi, malgré la présence d’un petit halo, l’antibio sera considéré comme résistant à la bactérie…

Le second seuil, noté « D », se rapporte quant à lui à la dose minimale administrée au malade. C’est en général celle que l’on prescrit.
Evidemment, si le diamètre du halo égale, ou dépasse la valeur de D, cela veut dire que l’antibio est efficace à des doses raisonnables, et on

pourra donc le prescrire en toute sécurité : la bactérie y est sensible.
Vous noterez enfin qu’entre les deux seuils que sont d et D, il y a une espèce de zone grise.
Si le diamètre du halo d’inhibition se trouve compris entre ces valeurs, on dit que la bactérie est intermédiaire : on ne sait pas trop dans quelle mesure l’antibio va fonctionner.
C’est pourquoi, lorsqu’on a le choix, on se tournera toujours vers des antibios face auxquels la bactérie est sensible.
Lorsque tous les antibios testés donnent un résultat intermédiaire, forcément, il faudra opter pour l’un d’entre eux. Mais dans ce cas, on le prescrira aux doses maximales acceptables.
Mais parfois, malheureusement, il arrive que la bactérie soit résistante à tous les antibiotiques à disposition. Il n’est alors plus possible de traiter le patient…
Avec l’avancée de l’antibiorésistance, ce cas de figure tragique va hélas se multiplier dans les années à venir,
et l’OMS prévoit même qu’à l’horizon 2050, 10 millions de morts chaque année dans le monde seront imputables à cette grave menace pour la santé publique humaine.
Voilà pourquoi, face au péril qui nous guette, plusieurs méthodes sont testées pour réveiller les consciences, y compris celle du meme.
Je ne sais pas vous, mais moi, je l’aime bien : il m’a arraché un sourire.

Toujours est-il qu’en attendant de mettre au point des alternatives aux antibiotiques, la meilleure chose à faire est encore de ne pas les prescrire à tort et à travers.
En cas d’infection il faut toujours s’assurer de son origine bactérienne.
Si l’infection est virale, les antibiotiques n’ont aucun effet, et leur emploi servira juste à vous faire griller un précieux joker…
On retiendra donc de ce thread que les antibiotiques, c’est pas automatique !
Parlez-en avec votre médecin.
Quant à moi, je vais maintenant repartir vers d’autres cieux.
Je vous remercie pour votre lecture, et si vous avez apprécié ce thread (et même dans le cas contraire, d’ailleurs), sentez-vous libre de le retweeter : ce sera pour moi une très belle récompense.

En attendant, voici mes anciennes productions si jamais il vous faut du rab…
Bonne fin de journée à tous !
